研究海水淡化及海水腐蚀的防护

姓 名 朱鹏宇 沙睿函 宋雨霏 孙妤彤
指 导 教 师 覃柳兰
学 校 徐州市第一中学
日 期 2023.9.17
研究海水淡化及海水腐蚀的防护
徐州市第一中学 朱鹏宇 沙睿函 宋雨霏 孙妤彤
指导教师 覃柳兰
【摘要】探究了铝箔材料对海水淡化效率的影响;不同浓度的NaCl溶液对铁铸材料的腐蚀程度;不同缓蚀剂对铁铸材料的缓蚀作用。经过动手搭建太阳能海水淡化设备,以及将其放在太阳下进行实验,收集得到蒸馏水,无铝箔材料的设备4小时凝结水收集量为1.25 mL,平均收集率为0.31;有铝箔材料的收集量为1.82 mL,平均收集率为0.46,数据证明铝箔材料对海水淡化的效率有提高作用。在探究不同浓度的NaCl溶液对铁铸材料的腐蚀程度的实验中,质量分数0%,2%,4%,6%,8%,10%,26.5%的NaCl溶液电流值分别135, 445, 535, 498, 529, 516,322 μA,呈先增后减趋势,实验证明,当溶液氯盐浓度为4%时,其对铁的腐蚀性最强,低于4%时,其浓度越高,对铁的腐蚀性越强;高于4%时,其浓度越高,对铁的腐蚀性越弱。在探究不同缓蚀剂对铁铸材料的缓蚀作用时,聚环氧琥珀酸的缓蚀性比四硼酸钠、十二烷基苯磺酸钠效果好,再结合经济成本、绿色环保等重要因素,选择聚环氧琥珀酸作缓蚀剂最为明智。
【关键词】海水淡化;腐蚀性;缓蚀剂;铁铸材料
一、研究背景
我国淡水资源缺乏,且时空分布不均。近年来,淡水资源的短缺和污染,成为经济增长的制约因素,严重影响着人类生存和社会发展。为了解决水的资源性危机,人们自然想到了浩瀚的大海,进行海水淡化。
海水淡化是将海水等含有高盐度的水转变为可以饮用或可用于灌溉的淡水的过程。海水淡化的原理源于大自然。在太阳的照射下,海水蒸发,通过雨雪露云霜雾的形式,变为淡水,洒落大地,滋养生灵。仿照大自然的循环蒸发,科学家模拟了自然界中淡水生产机理。通过科学技术让海水也变成洁净、味甘、清冽的纯净之水,流进寻常百姓家。
目前海水淡化技术以热法和膜法为主。热法是利用水蒸气冷凝的原理进行海水淡化。热法淡化海水主要有多级闪蒸和低温多效两种方法。膜法主要使用反渗透技术,利用反渗透膜的分离作用淡化海水。就是将海水预处理后用高压泵施压,使海水中的水分子透过膜渗出,而盐及其他物质被挡在膜外产生淡水。传统的海水淡化方法,技术成熟,工艺完善,已经实现大规模的工业化应用,但因消耗化石能源,会引发环境问题。开发利用太阳能、风能等可再生能源,是未来海水淡化技术的发展方向之一。在太阳能海水淡化技术研究方面,研究多集中在太阳能利用与热法海水淡化系统或膜法海水淡化系统耦合。
海水淡化效率会受到多种因素的影响,比如海水淡化装置材料、水温、蒸发面积、海水盐度等。海水淡化装置在使用过程中,会遇到各种各样的问题,比如管道堵塞、管道锈蚀等,造成管道锈蚀的因素有哪些?面临海水腐蚀现象,可采取什么措施?针对这些问题,本课题主要进行了以下三个方面的研究。
1.探究铝箔材料对海水淡化效率的影响。
2.探究不同浓度的NaCl溶液对铁铸材料的腐蚀程度。
3.探究不同缓蚀剂对铁铸材料的缓蚀效果。
二、实验材料
1.实验材料:海盐,自来水,铝箔,铁片,铁钉,搅拌棒,滴管,碳棒,塑料盒,烧杯,量筒,培养皿,保鲜膜,剪刀,直尺,砂纸,鳄鱼夹导线,镊子,一次性手套,透明胶带,标签纸。
2.实验仪器:电子秤,探头温度计,万用表。
3.试剂:四硼酸钠,十二烷基苯磺酸钠,聚环氧琥珀酸。
三、研究过程
课题一:海水淡化—铝箔材料对海水淡化效率的影响
1.实验步骤
1.1.实验准备:用剪刀和直尺将铝箔裁剪成50 cm*5 cm的一个长方形。
1.2.制作海水淡化装备:
①准备2个长方形塑料盒,其中一个编号为1号,另一个编号为2号;1号塑料盒不做任何处理,2号塑料盒的4个侧面用铝箔包裹(用胶带粘贴固定)。
②称量两份3.5 g海盐并分别倒入2个塑料盒中,同时在每个塑料盒中倒入100 mL自来水,用搅拌棒将其搅拌均匀,制成模拟海水。
③将2个培养皿用透明胶带密封好,分别放入2个装有模拟海水的塑料盒中,尽量放在塑料盒的中间位置。
④称量培养皿的皿底,记录重量。将2个皿底分别放到刚刚放置的培养皿上。
⑤将两个探头温度计分别粘在1号和2号塑料盒的内侧,但是不要触碰到液面。
⑥用保鲜膜遮住1号和2号塑料盒的内侧,但是不要触碰到液面。
⑦将一个铁片置于保鲜膜上,位置在培养皿皿底的正上方,轻轻按压铁片,使铁片在保鲜膜上形成一个低点,但要确保它不会低到保鲜膜接触到皿底。
⑧将2个组装好的海水淡化装置放到太阳照射的地方,将温度计放在旁边,以便记录环境温度。
1.3.实验测试:
①每半个小时查看海水淡化装置,保证铁片在皿底正上方的保鲜膜中形成一个低点,查看保鲜膜上的冷凝水情况,并如实记录。
②至少4小时后,将2个海水淡化装置取回,轻轻拍动保鲜膜20次,使保鲜膜上残留的水珠顺着铁片所形成的最低点进入其下方的皿底中。
③揭掉保鲜膜,将皿底取出,测量皿底和水珠的重量。
④重复实验,分析数据,得出结论。在不同的日期(保证当天阳光充足)至少再重复此实验两次,总共进行三次实验,观察现象并做记录。
课题二:海水腐蚀—基于电化学探究海水对铁铸材料的腐蚀
1.实验步骤
1.1.实验准备:准备7个100 mL烧杯,将写有1-7号的标签纸分别贴在烧杯上。
1.2.配置不同浓度的NaCl溶液:
①用电子秤分别称量2 g、4 g、6 g、8 g、10 g、26.5 g NaCl固体并倒入准备好的2-7号烧杯中。
②用量筒按照表1上的配置将一定量的清水注入到1-7号烧杯中。
表1 不同质量分数的NaCl液体配比表
编号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
质量分数 |
0% |
2% |
4% |
6% |
8% |
10% |
26.5% |
NaCl质量(g) |
0 |
2 |
4 |
6 |
8 |
10 |
26.5 |
自来水体积(mL) |
100 |
98 |
96 |
94 |
92 |
90 |
73.5 |
③用搅拌棒搅拌以上NaCl溶液,使固体充分溶解在清水中。溶解之后将部分溶液倒掉或者用滴管吸出,使得烧杯中所剩溶液为90 mL。
1.3.实验测试:
①使用鳄鱼夹导线将碳棒和万用表红色表笔连接,将铁钉(使用砂纸打磨光亮)与万用表黑色表笔连接。
②将铁钉和碳棒垂直放入到NaCl浓度为0的清水中(碳棒与烧杯底部接触,与溶液接触的长度为4.2 cm;铁钉不会接触到烧杯底部,铁钉与鳄鱼夹呈90度),铁钉与碳棒的距离为烧杯直径。
③打开万用表开关,调到测电流的档位,同时开始计时,记录2分钟后的电流值。
④按照步骤①测量浓度为2%、4%、6%、8%、10%、26.5%(饱和)的NaCl溶液中的电流值(每次测量前都要使用砂纸将铁钉打磨光亮、碳棒保证干燥)。
⑤总结电流值变化的规律,并分析形成的原因。
课题三:海水腐蚀的防护—探究不同缓蚀剂对铁铸材料的缓蚀作用
1.实验步骤
1.1.缓蚀溶液准备:
①准备好10个100 mL的塑料烧杯,并编号为1-10号。在每个烧杯中加入4 g氯化钠与96 mL的自来水,配制完成质量分数为4%的NaCl溶液共10份。
②1号溶液不做处理,在2-4号NaCl溶液中分别添加0.2 g、0.4 g、0.6 g四硼酸钠,并用搅拌棒搅拌使其溶解;在5-7号NaCl溶液中分别添加0.2 g、0.4 g、0.6 g十二烷基苯磺酸钠,并用搅拌棒搅拌使其溶解(溶解时间较长,24小时);在8-10号NaCl溶液中用滴管分别添加2滴、4滴、6滴聚环氧琥珀酸。
1.2.缓蚀速率测定:
①使用鳄鱼夹导线将碳钉棒和万用红色表笔连接,将铁钉(5 cm,使用砂纸打磨光亮)与万用表黑色表笔连接,之后将固定号的铁钉和碳棒垂直放入1号(4% NaCl溶液)中(碳棒与烧杯底部接触,碳棒与溶液接触的长度为5.4 cm;铁钉不会接触到烧杯底部,铁钉与鳄鱼夹呈90度),铁钉与碳棒的距离为烧杯直径。
②打开万用表开关,调到测电流的档位,同时开始计时,记录2分钟后的电流值。
③按照步骤①测量2-10号不同缓蚀剂NaCl溶液中的电流值(每次测量前都要使用砂纸将铁钉打磨光亮),总结电流值变化的规律,并分析形成的原因。
1.3.腐蚀率测定:
①取出1寸长的小铁钉100个,用砂纸表面打磨光亮后备用。
②将100个打磨好的小铁钉平均分成10组,每组10个铁钉。称量每组铁钉的质量为m0。
③将每组铁钉放入1-10号溶液中,浸泡24小时,浸泡完成后用镊子将铁钉拿出放到对应的培养皿上,将其放在空气中24小时。
④观察并记录每组铁钉的表面现象。
⑤用砂纸将处理的铁钉表面打磨干净,称重为m1。
⑥计算腐蚀率:(m0-m1)/m0*100%。
四、结果与分析
1、通过表1-2、1-3及图1-2可发现,无铝箔材料的海水淡化设备4小时的凝结水收集量是1.25 g,平均收集率是0.31g/h,有铝箔材料的海水淡化设备4小时的凝结水收集量是1.82g,平均收集率是0.46g/h,铝箔材料对海水淡化的效率有影响,有铝箔材料的海水淡化效率高于无铝箔材料的海水淡化效率。通过表1-1及图1-1可发现,有铝箔材料的海水淡化效率高于无铝箔材料的海水淡化效率。。
表1-1 铝箔材料对海水淡化收集装置的影响实验记录表
时间 |
无铝箔 |
有铝箔 |
环境温度(℃) |
||
盒内温度(℃) |
现象 |
盒内温度(℃) |
现象 |
||
30 min |
46.2 |
起少量水雾 |
52.0 |
起少量水雾 |
42.0 |
60 min |
50.3 |
形成小水珠 |
55.9 |
形成较多小水珠 |
47.0 |
90 min |
53.2 |
形成较大水珠 |
57.9 |
形成较多较大水珠 |
49.0 |
120 min |
51.8 |
形成更多水珠 |
55.6 |
形成更多更大水珠 |
46.0 |
150 min |
52.8 |
形成大量小水滴 |
56.2 |
形成大量水滴 |
47.0 |
180 min |
52.0 |
形成更多小水滴 |
55.9 |
形成面积为1 cm2的水滴 |
46.0 |
210 min |
44.8 |
形成大量大水滴 |
47.2 |
形成大量大水滴 |
44.0 |
240 min |
42.5 |
形成大量大水滴 |
45.2 |
形成大量大水滴 |
43.0 |
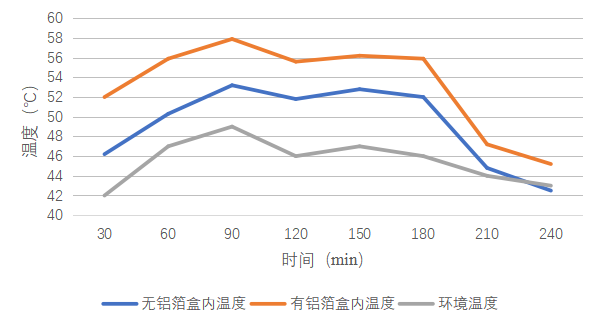
图1-1 不同情况下的温度随时间的变化情况
表1-2 铝箔材料对海水淡化收集装置的影响实验数据记录表
处理方式 |
收集量(g) |
||
重复1 |
重复2 |
重复3 |
|
无铝箔 |
0.00 |
1.77 |
0.73 |
有铝箔 |
0.07 |
2.35 |
1.29 |
表1-3 铝箔材料对海水淡化收集装置的影响实验数据整理表
处理方式 |
平均收集量(g) |
平均收集率(g) |
无铝箔 |
1.25 |
0.31 |
有铝箔 |
1.82 |
0.46 |
![]()
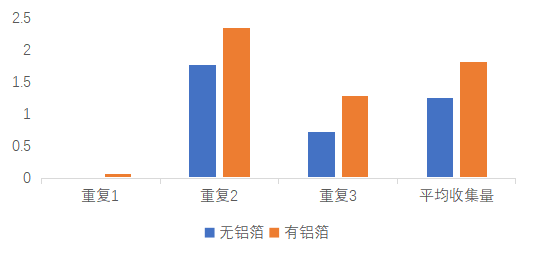
图1-2有无铝箔情况下的收集量情况
2、通过表2-1及图2-1可发现,随着NaCl溶液浓度的增加电流值呈现出先增后减的趋势,其中在浓度为4%时呈现出最大值。当溶液氯盐浓度低于4%时,其浓度越高,对铁的腐蚀强度越强;当溶液氯盐浓度为4%时,其对铁的腐蚀强度最强;当溶液氯盐浓度高于4%时,其浓度越高,对铁的腐蚀强度越弱。这一现象产生的原因是:①在电化学原理中,Nacl溶液腐蚀铁的金属时,产生化学反应,在此过程中产生电流,需要氧参与。随着Nacl溶液浓度增大,溶液中氧含量降低,当氧含量降低至一定程度时,电化学反应受到抑制。②已生成的铁锈阻止了化学反应的生成。
表2-1 不同浓度NaCl溶液对铸铁材料的腐蚀实验记录表
编号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
质量分数 |
0% |
2% |
4% |
6% |
8% |
10% |
26.5% |
电流值/μA |
135 |
455 |
535 |
498 |
529 |
516 |
322 |
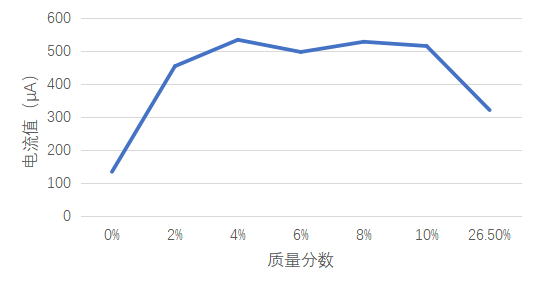
图2-1 随着NaCl溶液浓度的增加电流值的趋势图
3、通过表3-1及图3-1,可发现缓蚀剂对铁的腐蚀有一定的缓解作用,不同缓蚀剂的缓蚀效果不同,具体表现为聚环氧琥珀酸的缓蚀效果最好,四硼酸钠次之,十二烷基苯磺酸钠最差。其中在一定浓度内,四硼酸钠随着浓度的增加,缓蚀效果越好,十二烷基苯磺酸钠随着浓度的增加,缓蚀效果越好,聚环氧琥珀酸随着浓度的增加,缓蚀效果越好。在腐蚀率的计算中发现,在一定时间内,4%的NaCl溶液对铁的腐蚀率为5.91%,添加十二烷基苯磺酸钠的NaCl溶液对铁的腐蚀率为5.02%,添加四硼酸钠的NaCl溶液对铁的腐蚀率为4.85%,添加聚环氧琥珀酸的NaCl溶液对铁的腐蚀率为9.11%。在考虑缓蚀效果、经济成本、绿色环保的前提下,在三种缓蚀剂中选择聚环氧琥珀酸更为明智。
表3-1 不同缓蚀剂的NaCl溶液电流数据记录整理表
编号 |
经过处理的铁钉表面描述 |
铁钉原始重量m0(g) |
经过处理的铁钉重量m1(g) |
铁钉腐蚀率 (m0-m1)/m0*100% |
1 |
有很明显的生锈现象,表面附着大量红色氧化物 |
4.90 |
4.61 |
5.91 |
2 |
有较为明显生锈现象,表现附着明显红褐色氧化物 |
4.90 |
4.63 |
5.51 |
3 |
生锈现象不明显,铁钉表面附着少量红色氧化物 |
4.90 |
4.71 |
3.88 |
4 |
有明显生锈现象,铁钉表面斑驳可见红褐色氧化物 |
4.90 |
4.64 |
5.31 |
5 |
有非常明显生锈现象,铁钉表面附着红褐色氧化物较多 |
4.90 |
4.64 |
5.31 |
6 |
有非常明显生锈现象,铁钉表面红褐色氧化物较多 |
4.90 |
4.59 |
6.33 |
7 |
有很明显生锈现象,铁钉表面包裹较多红色氧化物 |
4.90 |
4.73 |
3.47 |
8 |
有较为明显生锈现象,铁钉表面附着较多红色氧化物 |
4.90 |
4.58 |
6.53 |
9 |
生锈现象不明显,铁钉表面可见少量斑驳氧化斑 |
4.90 |
4.42 |
9.79 |
10 |
生锈现象较为不明显,铁钉表面可见少量红褐色氧化物 |
4.90 |
4.36 |
11.02 |
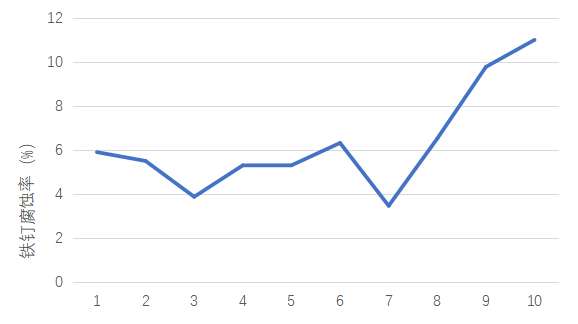
图3-1 不同缓蚀剂的NaCl溶液对铁钉的腐蚀率情况
五、结论
1、铝箔材料影响海水的淡化效率,有铝箔材料的海水淡化效率高于无铝箔材料的海水淡化效率。
2、实验发现氯盐浓度高低对铁铸材料的腐蚀程度不同。可见含盐量是影响海水腐蚀的因素之一。海水的盐度波动直接影响到海水的比电导率,比电导率又是影响金属腐蚀速度的一个重要因素,同时因海水中含有大量的氯离子,破坏金属的钝化,所以很多金属在海水中遭到严重腐蚀。盐类以Cl-为主,一方面:盐浓度的增加使得海水导电性增加,促进了阳极反应,使海水腐蚀性很强;另一方面:盐浓度增大使溶解氧浓度下降,超过一定值时金属腐蚀速度下降。
3、使用缓蚀剂能有效地减慢金属在海水中的腐蚀速率。实验中的三种缓蚀剂:聚环氧琥珀酸、四硼酸钠、十二烷基苯磺酸钠对比来看,聚环氧琥珀酸的缓蚀效果最好,四硼酸钠次之,十二烷基苯磺酸钠最差。同时聚环氧琥珀酸生物降解性能好,应用范围广泛。在考虑缓蚀效果、经济成本、绿色环保的前提下,在三种缓蚀剂中选择聚环氧琥珀酸更为明智。
六、参考文献
[1]柴子华,刘学芝.浅论海水制盐未来发展趋势[J].中国盐业,2018(03):45-48.
[2]任保泉.浓海水与制盐工艺对接模式的探讨[J].盐业与化工,2014,43(10):1-2.
[3]李顺涛,陈华,亢淑梅,等.高锰钢海水腐蚀电化学行为研究[J].宽厚板,2022,47(02):330-339.
[4]林中楠,马海涛,王来,等.纯铁在流动海水中的电化学腐蚀行为[J].材料保护,2009,42(07):14-17.
[5]王曰义.铸铁在流动海水中的腐蚀行为[J].装备环境工程,2005(05):68-73.
[6]韩国进,刘英坤.海底管道表面锈层对缓蚀剂效果的影响 [J].全面腐蚀控制,2019,33(01):47-51.
附录