研究海水淡化及海水腐蚀的防护
研究海水淡化及海水腐蚀的防护
姓 名 黄慕青 侯奕如 张祎卓 郭恩同
指 导 教 师 覃柳兰
学 校 徐州市第一中学
日 期 2023.9.16
研究海水淡化及海水腐蚀的防护
黄慕青 侯奕如 张祎卓 郭恩同
指导教师:覃柳兰
【摘要】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。加强对海水资源的开发利用,是解决沿海和西部苦咸水地区淡水危机和资源短缺问题的重要措施,是实现国民经济可持续发展战略的重要保证。海水淡化,是开发新水源、解决沿海地区淡水资源紧缺的重要途径。随着全球人口的迅速增长和水资源的日益短缺,海水淡化技术成为解决淡水供应问题的重要手段。然而,海水中存在的高盐度和腐蚀性成分,给海水淡化设备的运行和维护带来了巨大挑战。本文对海水淡化技术和海水腐蚀防护进行了综述,概述了海水淡化的常用方法之一——蒸馏法及影响其效率因素和使用不同缓蚀剂对海水腐蚀防护作用的影响,并对海洋资源合理利用与未来研究方向进行了展望。
【关键词】海水淡化;蒸馏法;腐蚀防护;缓蚀剂
一、研究背景
全球水的总储量为136亿立方公里,海水就占有97.2%,但人类可取用的地表水和浅层地下水仅为0.65%,且随地域和季节变化分布极不均匀。海水淡化不仅是某一国家和地区,某一时期的暂时性的局部问题,也是世界范围内涉及人类生存和社会发展的长远而重大的问题。向占全球水总储量97.2%的海水要水,是解决沿海地区水资源短缺的战略途径,是繁荣沿海经济的重要措施。世界上已有一亿多人口靠海水淡化解决用水的问题。用海水淡化技术向大海要淡水,满足沿海城镇和岛屿对淡水的需求或紧急需求,是完全可行的,在许多情况下是经济的。
二、实验材料
1.实验仪器:铝箔纸胶带,配重块,砂纸,标签纸,碳棒,量简100mL,手套,铁钉100个,电子秤及称量纸,万用表及表笔,鳄鱼夹导线,数显温度计,烧杯100mL,塑料盒,搅拌棒,温度计,药匙,镊子,海盐,烧杯300mL,培养皿4个,滴管3mL,铁钉2寸
2.试剂:十二烷基苯磺酸钠,四硼酸钠,聚环氧琥珀酸
三、研究过程
1. 铝箔材料对海水淡化效率的影响
1.1 实验准备:
用剪刀和直尺将铝箔裁剪成50cm*50cm的1个长方形;
1.2制作海水淡化装备:
①准备2个长方形塑料盒,其中一个编号为1号,另一个编号为2号;1号塑料盒不做任何处理,2号塑料盒的4个侧面用铝箔包裹(用胶带粘贴固定)。
②称量两份3.5g海盐并分别倒入2个塑料盒中,同时在每个塑料盒中倒入100mL自来水,用搅拌
棒将其搅拌均匀,制成模拟海水。
③将2个培养皿用透明胶带密封好,分别放入2个装有模拟海水的塑料盒中,尽量放在塑料盒的中间位置。
④称量培养皿的皿底,记录重量。将2个皿底分别放到刚刚放置的培养皿上。⑤将两个探头温度计分别粘在1号和2号塑料盒的内侧,但是不要触碰到液面。⑥用保鲜膜遮住1号和2号塑料盒的最上面并将其上表面铺平,将四周用透明胶带密封。
⑦将一个铁片置于保鲜膜上,位置在培养皿皿底的正上方,轻轻按压铁片,使铁片在保鲜膜上形成一个低点,但要确保它
不会低到保鲜膜接触到皿底,
⑧将2个组装好的海水淡化装置放到太阳照射的地方,将温度计放在旁边,以便记录环境温度。
1.3实验测试
①每半个小时查看海水淡化装置,保证铁片在皿底正上方的保鲜 膜中形成一个低点,查看在保鲜膜上的冷凝水情况,并如实记录
②至少4小时后,将2个海水淡化装置取回,轻轻拍动保鲜膜20次,使保鲜膜上残留的水珠顺着铁片所形成的最低点进入其下方的皿底中。
③揭掉保鲜膜,将皿底取出,测量皿底和水珠的重量。 重复实验,分析数据,得出结论:在不同的日期(保证当天阳光充足)至少再重复此实验两次,总共进行三次试验,观察现象并做记录。
2. 基于电化学探究海水对铁铸材料的腐蚀
2.1实验准备:
准备7个100mL烧秆、将写有1-7号的标签纸分别贴在烧杯上。
2.2配制不同浓度的Nacl 溶液:
①用电子秤分别称量2g、4g、6g、8g、 10g、26.5gNaCI固体并倒入准备好的2-7号烧杯中。
②用量简按照表1上的配置将一定量的清水注入到1-7号烧杯中。
③用搅拌棒搅拌以上NaCl 溶液,使固体充分溶解在清水中。溶解之后将部分溶液倒掉或者用滴管吸出,使得烧杯中所剩溶液为90mL(按照实际情况,可调整到80mL)(3)实验测试:
①使用鳄鱼夹导线将碳棒和万用表红色表笔连接,将铁钉(使用砂纸打磨光亮)与万用表黑色表笔连接。
②将铁钉和碳棒垂直放入到NaC1浓度为0的清水中(碳棒与烧杯底部接触,与溶液接触的长度为4.2cm;铁钉不会接触到烧杯底部,铁钉与鳄鱼夹呈90°,如果烧杯溶液为80mL,则铁钉与溶液的接触长度为2.8cm),铁钉与碳棒的距离为烧杯直径。
③打开万用表开关,调到测电流的档位,同时开始计时,记录2分钟后的电流值。
④按照步骤国测量浓度为2%、4%、6%、8%、10%、26.5%(饱和)的NaCl溶液中的电流值(每次测量前都要使用砂纸将铁钉打磨光亮、碳棒保证干燥)。
⑤总结电流值变化的规律,并分析形成的原因。
3.探究不同缓蚀剂对铁铸材料的缓蚀运用
3.1缓蚀溶液准备:
①准备好10个100mL的塑料烧杯,并编号为1-10号。在每个烧杯中加入4g氯化钠与96mL的自来水配制完成质量分数为4%的NaC1溶液共10份。
②1号溶液不做处理,在2-4 号NaCI 溶液中分别添加0.2g、0.4g、0.6g 四硼酸钠,并用搅拌棒搅拌使其溶解;在5-7号NaC1 溶液中分别添加0.2g、0.4g、0.6g十二烷基苯硝酸钠,并用搅拌棒搅拌使其溶解(溶解时间较长,24小时);在8-10号NaCI溶液中用滴管分别添加2滴、4滴、6滴聚环氧琥珀酸(PESA)。
3.2缓蚀速率测定:
①使用鳄鱼夹导线将碳钉棒和万用表红色表笔连接,将铁钉(5cm,使用砂纸打磨光亮)与万用表黑色表笔连接,之后将固定好的铁钉和碳棒垂直放入1号(4%NaC1 溶液)中(碳棒与烧杯底部接触,碳棒与溶液接触的长度为5.4om;铁钉不会接触到烧杯底部,铁钉与鳄鱼夹呈 90,如果烧杯洛液为 96mL,则铁钉与洛液的接触长度为3.5 cm),铁钉与碳梅的距离为烧杯直径。
②打开万用表开关,调到测电流的档位,同时开始计时,记录2分钟后的电流值。
③按照步骤①测量2-10号不同缓蚀剂NaCI 溶液中的电流值(每次测量前都要使用砂纸将铁钉打磨光亮),总结电流值变
化的规律,并分析形成的原因。
3.3腐蚀率测定:
①取出1寸长的小铁钉100个,用砂纸将表面打磨光亮后备用。
②将100个打磨好的小铁钉平均分成10组,每组10个铁钉。称量每组铁钉的重量为m₀
③将每组铁钉放入1-10号溶液中,浸泡24小时,浸泡完成后用镊子将铁钉拿出放到对应的培养皿上,将其放在空气中24小时。(可根据当时做实验的气候条件,将浸泡和晾晒时间延长或缩短)。观察并记录每组铁钉的表面现象。用砂纸将处理的铁钉表面打磨干净,称重为m。计算腐蚀率:(m₀-m₁)/m₀*100%。
四、结果与分析
表1有无铝箔材料的温度变化
时间(分) |
无铝箔盒内温度(℃) |
有铝箔盒内温度(℃) |
环境温度(℃) |
30 |
46 |
46.9 |
42 |
60 |
47.1 |
47.9 |
43.1 |
90 |
44.3 |
45.4 |
42 |
120 |
39.3 |
39.5 |
41.5 |
150 |
46.7 |
46.9 |
40.1 |
180 |
43.1 |
44.3 |
39 |
210 |
39 |
39.6 |
38.3 |
240 |
40.2 |
41.3 |
38 |
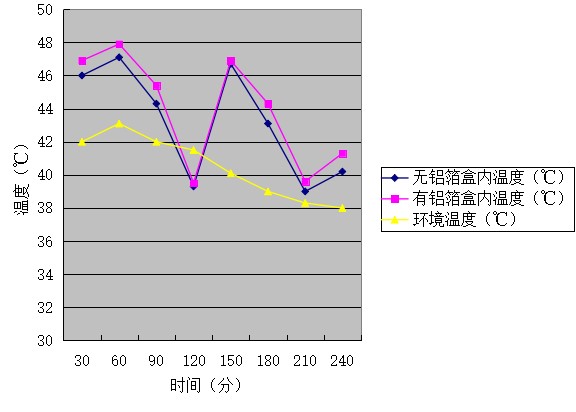
图1 有无铝箔材料随着时间变化其温度变化的对比情况
表2有无铝箔材料对淡水的收集量及收集率
平均收集量(克) |
平均收集率(克/小时) |
|
无铝箔 |
0.66 |
0.17 |
有铝箔 |
0.99 |
0.25 |
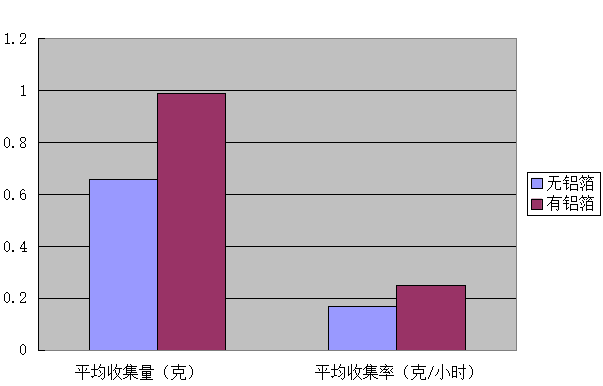
图2有无铝箔材料对海水淡化收集量及平均收集率的影响情况
通过图1、图2可看出,无铝箔材料的海水淡化设备4小时的凝结水收集量0.66克,平均收集率是0.17克/小时,有铝箔材料的海水淡化设备4小时的凝结水收集量0.99克,平均收集率是0.25克/小时;铝箔材料对海水淡化的效率有影响,即有铝箔材料的海水淡化效率高于无铝箔材料的海水淡化效率。 通过分析记录的温度及收集量数据可得出温度越高冷凝水的产量越多。
表3不同浓度NaCL溶液对铸铁材料的腐蚀实验
对应组 |
浓度(%) |
电流值(μA) |
1 |
0% |
218 |
2 |
2% |
527 |
3 |
4% |
592 |
4 |
6% |
630 |
5 |
8% |
590 |
6 |
10% |
563 |
7 |
26.5% |
451 |
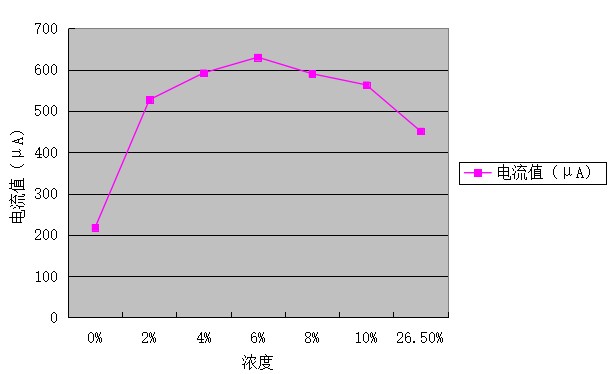
图3不同浓度NaCL溶液对铸铁材料的腐蚀情况
通过图3可看出,随着NaCl溶液浓度的增加电流值呈现出先增后减的趋势,其中在浓度为6%时呈现出最大值。所以,在一定范围内溶液浓度越高,对铁的腐蚀强度越强;当达到一定的值后,其浓度越高腐蚀强度减少。因为一方面:盐浓度的增加使得海水导电性增加,促进了阳极反应、使海水腐蚀性很;另一方面:浓度增大使溶解氧含量下降,超过一定值时金属腐蚀速度下降。
表4不同缓蚀剂对铁铸材料的缓蚀效果
对应组 |
0 |
1 |
2 |
3 |
四硼酸钠腐蚀率(%) |
1.08 |
1.3 |
0.86 |
0.65 |
十二烷基本磺酸钠腐蚀率(%) |
1.08 |
0.83 |
1.4 |
1.38 |
环氧琥珀酸腐蚀率(%) |
1.08 |
1.5 |
1.29 |
0.43 |
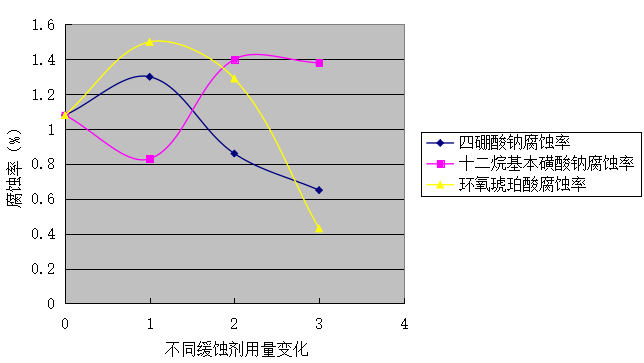
图4不同缓蚀剂对铁铸材料的缓蚀效果对比
通过图4可看出, 缓蚀剂对铁的腐蚀有一定的缓解作用,不同缓蚀剂的缓蚀效果不同,具体表现为环氧琥珀酸的缓蚀效果最好,四硼酸钠次之,十二烷基苯磺酸钠最差。其中在一定浓度内,四硼酸钠随着浓度的增加,缓蚀效果越好,十二烷基苯磺酸钠随着浓度的增加,缓蚀效果先好后差,聚环氧琥珀酸随着浓度的增加,缓蚀效果越好。 在腐蚀率的计算中发现,在一定时间内,4%的NaCl溶液对铁的腐蚀率为1.08% ,添加十二烷基苯磺酸钠的NaCl溶液对铁的腐蚀率为 0.83% 、1.40% 、1.38%,添加四硼酸钠的NaCl溶液对铁的腐蚀率为 1.3% 、0.86%、 0.65% ,添加环氧琥珀酸的NaCl溶液对铁的腐蚀率为 1.5%、 1.29%、 0.43% 。 在考虑缓蚀效果、经济成本、绿色环保的前提下,在三种缓蚀剂中选择环氧琥珀酸更为明智
表5 不同温度NaCL溶液对铸铁材料的腐蚀实验
温度(℃) |
电流值(μA) |
10 |
503 |
20 |
512 |
30 |
549 |
40 |
530 |
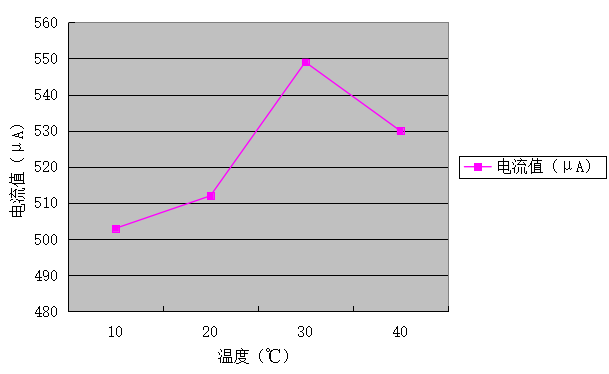
图5 NaCL溶液在不同温度变化下对铸铁材料的腐蚀情况
本实验属于小组内的拓展实验。通过图5可看出,随着NaCl溶液温度的升高电流值呈现出先增后减的趋势,其中在浓度为30℃时呈现出最大值。所以,在一定范围内溶液温度越高,对铁的腐蚀强度越强;当达到一定的值后,其温度越高腐蚀强度减少。因为一方面:NaCl溶液温度升高氧的扩散速度加快,海水导电率增大,这加速了阴极和阳极的反应,即腐蚀的加速,使海水腐蚀性很强;另一方面:NaCl溶液温度升高到一定程度时,氧在海水中的溶解度降低,使腐蚀减轻,使得金属腐蚀速度下降。
五、结论
1.温度越高,海水淡化效率越高,冷凝水的产量越多。
2.随着NaCl溶液浓度的增加电流值呈现出先增后减的趋势。一方面,在一定范围内溶液浓度越高,对铁的腐蚀强度越强;另一方面,当溶液浓度达到一定值后,其浓度越高腐蚀强度减少。
3.缓蚀剂对铁的腐蚀有一定的缓解作用。不同缓蚀剂的缓蚀效果不同,具体表现为环氧琥珀酸的缓蚀效果最好,四硼酸钠次之,十二烷基苯磺酸钠最差。
4、随着NaCl溶液温度的增加电流值呈现出先增后减的趋势。一方面,在一定范围内NaCL溶液温度越高,对铁的腐蚀强度越强;另一方面,当溶液温度达到一定的值后,其温度越高腐蚀强度减少。
六、参考文献
[2] 李建同,李亚楠. 海水淡化仪表选型一般原则[J]. 仪器仪表用户,2023,30(8):104-108. DOI:10.3969/j.issn.1671-1041.2023.08.025.
[3] 李毓林,靳国厚. 海水淡化技术[J]. 黑龙江水利科技,2001,29(4):38,45. DOI:10.3969/j.issn.1007-7596.2001.04.022.
[4] 华丽红. 海水淡化技术研究[J]. 科学与财富,2017(18):148-148. DOI:10.3969/j.issn.1671-2226.2017.18.143.
[5] 常纪文,张建红,宿宇. 海水淡化规模化利用问题与建议[J]. 中国水利,2022(13):44-46. DOI:10.3969/j.issn.1000-1123.2022.13.022.
[6] 刘可忠,朱明. 海水淡化的缺点分析[J]. 人民长江,2009,40(1):63-64,66. DOI:10.3969/j.issn.1001-4179.2009.01.024.
[7] 于德贤,于德良,韩彬,等. 膜蒸馏海水淡化研究[J]. 膜科学与技术,2002,22(1):17-20. DOI:10.3969/j.issn.1007-8924.2002.01.005.
[8] 宋瀚文,宋达,张辉,等. 国内外海水淡化发展现状[J]. 膜科学与技术,2021,41(4):170-176. DOI:10.16159/j.cnki.issn1007-8924.2021.04.022.
[9] 陈翔祥,张朴,曾鲜,等. 海洋环境中钢结构耐湿硫化氢/海水腐蚀防腐涂层研究现状[J]. 材料保护,2023,56(8):157-167. DOI:10.16577/j.issn.1001-1560.2023.0199.
- 附件【过程图片.jpg】
- 附件【过程图片2.jpg】
- 附件【课题二.mp4】
- 附件【课题一.mp4】
- 附件【课题三.mp4】
- 附件【拓展实验.mp4】
- 附件【2023徐州一中-海水淡化-jp04g08-开箱视频.mp4】
- 附件【开箱照片.jpg】
- 附件【开箱视频2.mp4】
- 附件【海水淡化-jp04g08-PPT.pptx】
