细胞发酵与无细胞发酵差异及影响酶活性因素探究
探究无细胞发酵的过程
——复现诺奖经典实验
姓 名 |
顾清源、李大鹏、侯卓然 |
指导教师 |
杨慧 |
学 校 |
徐州市第一中学 |
日 期 |
2021年10月31日 |
探究无细胞发酵的过程——复现诺奖经典实验
徐州一中 顾清源 李大鹏 侯卓然 李家慧
指导老师:闻婧
【摘要】:毕希纳的实验在1896年完成,并于1897年以《无酵母细胞的乙醇发酵》为题在杂志上宣布了这个发现,一下震动整个科学界。对于无细胞发酵机制的分析表明,可以用化学反应来阐明复杂的代谢过程,每一个化学反应都可以由一种特殊的酶来催化,这种化学确切地说,称为生命的化学或者生物化学。毕希纳关于无细胞酵解的“偶然”发现为现代生物化学研究打开了一个崭新领域,为20世纪生物化学的迅猛发展吹响了启动的号角,这对生物化学乃至整个生命科学发展都具有重大的意义。
【关键词】:无酵母细胞;发酵;酶;催化
一、研究背景
该实验打破活力论的桎梏,使科学家认识到许多复杂生命问题可在酵母细胞的体外进行研究,从而激发大批科学家投身生物化学领域。19世纪末,科学界还缺乏生物化学独立学科,而无细胞酵解发无疑推动了该领域的发展,1905年生物化学专业杂志出现宣告该学科的诞生,为20世纪生命科学的发展奠定坚实的基础。该发现带来更多、更大的问题,如酵素本质(酶的问题)、蔗糖转化乙醇机制(代谢问题)等,对这些问题的究成为生物化学的中心,因此称其为奠基作用一点都不为过。毕希纳并没有进一步阐明酵解的机制,但却促使一大批科学家开始研究,特别是将这些问题转移到化学家的实验室,成为化学家试管中的一项重要研究内容毕希纳证明酵母汁可代替活酵母进行催化,从而为应用带来便利,因为酵母汁保存比活酵母要容易得多,这开了酶及蛋白应用的大门。通过复现该实验,我们可以探究无细胞发酵的过程,进一步了解有细胞和无细胞发酵的区别。
二、 实验材料
1.实验仪器:石英砂、活性干酵母、显微镜、针管、橡胶管、盖玻片、载玻片、研钵、电子天平、剪刀、滤纸、药匙、点滴板、塑料瓶、笔、冰袋等
2.试剂:干酵母,蔗糖,清水。
三、研究过程
1) 研究过程酵母处理及研磨:
a. 有冰箱或制冷装置情况下可使用此操作:
①准备:将干酵母和研钵置于-20℃冰箱中冷冻1h(或用冰袋制冷2-3h);
②研磨:用电子天平城区1g冷冻的干酵母置于研钵中;再加入1g石英砂,研磨约5min,置于-20℃冰箱中冷冻1h(活用冰袋制冷2-3h)后取出再次研磨15min;
③观察:取少量(约0.1g)研磨后的粉末加入点滴板的一个槽内,滴加5滴清水,滴管吹打混匀后吸取一滴置于载玻片上,盖上盖玻片,于显微镜下观察,若可看到较多酵母细胞,需向研钵中添加6mL清水,继续研磨约5min,取一滴研磨后的混合液观察,重复此步骤,直至在显微镜下,看到较少酵母细胞;
b. 无冰箱或冰袋情况下可使用此操作:
① 研磨:用电子天平称取1g活性干酵母,置于研钵中,再加入1g石英砂,研磨约5min;
② 观察:取少量(约0.1g)研磨物置于点滴板的一个槽里,滴加5滴清水,混匀,用滴管吸取1滴置于载玻片上,盖上盖玻片,于显微镜下观察,若可以看到较多酵母细胞,需向研钵中添加6mL清水,继续研磨约5min,取一滴研磨后的混合液观察,重复此步骤,直至在显微镜下,看到较少酵母细胞
2) 准备破碎酵母提取液:
方法一:离心:将酵母混合液倒入10mL离心管,注入清水,使两支离心管质量基本一致,放入离心机对角位置,于2000r/min离心10min,得到上清液;
方法二:过滤:取1张滤纸,十字形折叠,使其成为漏斗状,放置于30mL塑料瓶口,过滤酵母菌混合液,得到过滤液约2mL;
3) 检查提取液中是否存在活酵母:吸取一滴上清液或过滤液在载玻片上,盖上盖玻片,于显微镜下观察,若无酵母细胞,说明得到的为提取液,若有酵母细胞,则需重新过滤,直至看不到酵母细胞;
4) 针筒皮管准备:取5支5mL针管,用记号笔标记为1、2、3、4、5;用剪刀将皮管剪成5段,每段10cm;
5) 染料溶液制备:取30mL塑料瓶,向瓶中加入约10mL清水,滴入一滴颜料,混匀备用;
6) 注入蔗糖溶液及酵母提取液:将针筒塞拔出,按照表2-1,用滴管向每个针筒中加入对应添加物,放入针筒塞,使针筒小口端朝上,将针筒塞推至3mL刻度处;
表2-1 不同处理下的添加物质表(无细胞发酵)
序号 添加物 |
1 |
2 |
3 |
4 |
5 |
水 |
0.5 |
- |
0.5 |
- |
0.5 |
10%蔗糖溶液 |
- |
0.5 |
0.5 |
- |
- |
30%蔗糖溶液 |
- |
- |
- |
0.5 |
0.5 |
酵母提取液 |
0.5 |
0.5 |
- |
0.5 |
- |
7) 皮管内注入染料溶液:用滴管吸取步骤5)制备好的染料溶液,从一端滴入皮管,注入液滴的体积约占皮管2mm,使皮管竖立,轻轻敲动,使液滴下落至距离皮管端口约1cm处;
8) 做标记:将带有液滴的皮管安装在针筒上,水平放置于桌面,静置5-10min(放止热胀冷缩),用圆珠笔对液滴在皮管中的位置做标记;
9) 观察与记录:在反应0、10min、20min、30min时用圆珠笔在皮管上记录有色液滴移动的方向与距离,0min时液滴所在位置记为初始位置,若远离针筒方向移动则记为正值,若靠近针筒方向移动则记为负值;反应30min后,卸下装置,用直尺测定液滴移动距离,并记录在表2-2中。
注意事项:
a. 研磨时要均匀研磨,避免细胞破碎不完全。
b. 研磨过程中要不断取酵母提取液观察酵母破碎情况。
c. 酵母研磨后可根据情况多加水,但注意稀释倍数越大,现象越不明显。
d. 尽量保持每个皮管里的有色液滴距离针管的距离相同。
e. 圆珠笔做标记时,要选择液滴的同一侧进行标记。
f. 液滴移动距离测定开始后,不能移动针筒,以防受人为因素产生较大误差。
四、结果与分析
测定指标 针筒编号 |
液滴移动距离(mm) |
反应后是否有气泡 |
|||
0min |
10min |
20min |
30min |
||
1 |
0 |
2 |
4 |
7 |
有 |
2 |
0 |
5 |
7 |
12 |
有 |
3 |
0 |
0 |
0 |
0 |
无 |
4 |
0 |
5 |
6 |
10 |
有 |
5 |
0 |
0 |
0 |
0 |
无 |
表2-2不同处理下液滴移动距离实验数据表(无细胞发酵)数据记录表
注:某时刻液滴移动距离为:从0至此时刻下液滴同一端距离初始位置的距离。
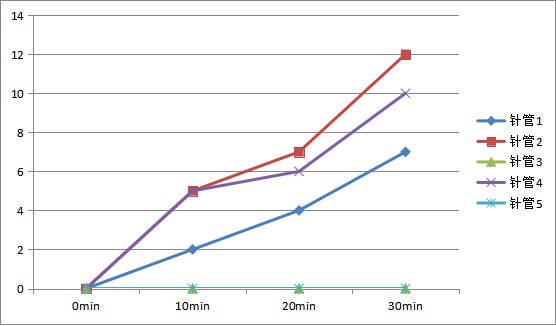
不同处理下液滴移动距离实验数据表(无细胞发酵)数据记录折线图
五、结果与讨论
通过实验,我们发现: 在0-30min内,蔗糖浓度为0、10%、30%时可以观察到皮管里的液滴向外移动,同时针筒内没有气泡产生,以上现象说明酵母提取液可以进行发酵。 质量分数为10%和30%的蔗糖溶液对发酵的影响有区别,具体表现为:加入10%蔗糖溶液的针管液滴移动更快,距离更远。推测原因可能是:在10%的蔗糖溶液中,发酵效果最好。
附录


- 附件【无细胞发酵 顾清源.pptx】
- 附件【15min.mp4】
- 附件【05e286b2a577712cae51b175a74ab37a.mp4】
- 附件【25min.mp4】
- 附件【d435bf65a32ea81df112ab72a747841f.mp4】
